| |
 |
|
Reactievergelijkingen |
© h.hofstede (h.hofstede@hogeland.nl)
|
|
| |
Als je twee of meer
stoffen bij elkaar gooit dan gebeurt er soms iets. Niet altijd, maar
soms. Sommige stoffen "reageren op elkaar". Soms een klein beetje, soms
heel heftig (net zoals sommige mensen trouwens). Wat er dan gebeurt is,
dat de atomen waar de stoffen uit bestaan zich anders met elkaar gaan
verbinden, zodat er nieuwe stoffen ontstaan.
Het is erg belangrijk dat er daarbij van elke soort geen atomen
verdwijnen of bijkomen. Die dingen zijn namelijk haast niet kapot te
krijgen.
|
Het aantal atomen van elke soort is voor en na een
reactie gelijk. |
|
| |
Voorbeeld.
Een voorbeeld is de reactie van de verbranding van aardgas.
Aardgas is de stof CH4 dus een molecuul aardgas
bestaat uit één atoom koolstof (C) en vier atomen waterstof (H), en als
je daar zuurstof (O2; twee atomen dus) bij doet, en de
temperatuur hoog genoeg maakt, dan vindt er een reactie plaats.
De C's en H's en O's worden als het ware uit elkaar
getrokken en gaan nieuwe verbindingen aan. Het is gewoon een soort
partnerruil!!!
Ze komen na afloop
tevoorschijn als koolzuur (CO2) en water (H2O).
Je zou dat zó op kunnen schrijven: CH4 + O2
→
CO2 + H2O
waarbij aan de linkerkant van de pijl de stoffen vóór de reactie staan
en aan de rechterkant de stoffen ná de
reactie. Scheikundigen noemen zo'n regel als deze (die aangeeft welke
stoffen er vooraf en na afloop zijn) een reactievergelijking. |
| |
Maar wacht eens even....
dat klopt niet....!
Waarom niet?
Nou... er zijn hier ineens zomaar atomen verdwenen en bijgekomen.
Aan de linkerkant staan bijvoorbeeld vier H-atomen, en aan de
rechterkant maar twee.
Aan de linkerkant staan twee O-atomen en aan de rechterkant ineens drie!
Er kunnen echt geen H-atomen verdwijnen of O-atomen bijkomen.
De oplossing voor dit probleem is: verander het aantal moleculen
in de reactievergelijking, en probeer dat zó te doen dat de vergelijking
voor elke soort atomen wél klopt. Dat heet het kloppend maken
van een reactievergelijking.
Je zou bij bovenstaande reactievergelijking zó kunnen redeneren: |
| |
|
|
|
|
CH4 + O2
→
CO2 + H2O |
| |
|
|
|
|
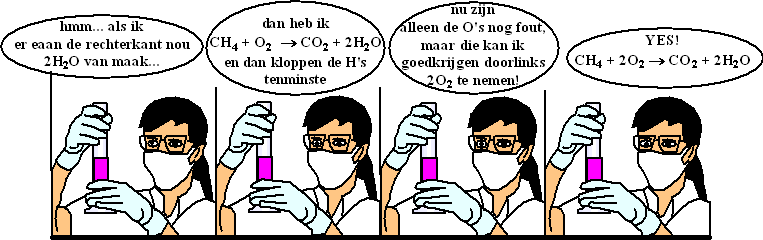 |
| |
|
|
|
Met een beetje
proberen geeft dat de reactievergelijking CH4 + 2O2
→ CO2
+ 2H2O
Maar GATVERDAMME wat een lelijke methode!!
Een beetje proberen.....jaja....Typisch iets voor scheikundigen!!!
Wij wiskundigen gruwelen natuurlijk van deze volkomen
onwetenschappelijke manier
Laten we het wiskundiger
aanpakken!
Kijk, het probleem was om in de reactievergelijking .....CH4
+ ......O2 →
.....CO2 + ......H2O op die stippeltjes iets
in te vullen waardoor de aantallen atomen van elke soort kloppend
werden.
Dat doen we natuurlijk niet door zomaar wat te proberen, nee, dat doen
we door er variabelen neer te zetten!
Stel de vergelijking a
• CH4 + b • O2
→
c • CO2
+ d • H2O,
met a, b, c en d voorlopig nog onbekend.
Dan kun je voor elke soort atomen een vergelijking opstellen die eist
dat de aantallen aan de linkerkant en een de rechterkant gelijk zijn: |
| |
|
|
|
| de C-vergelijking: |
a = c |
| de H-vergelijking: |
4a = 2d |
| de O-vergelijking: |
2b = 2c + d |
|
| |
|
|
|
Maar..... er is een
probleem.
Dit zijn drie vergelijkingen met 4 onbekenden, en dat stelsel is niet op
te lossen. Dat geeft oneindig veel oplossingen.
Eigenlijk hadden we dat al wel kunnen vermoeden, want uiteraard zijn er
oneindig veel oplossingen! Als je alle getallen in een kloppende
reactievergelijking met twee vermenigvuldigt klopt ie nog steeds. En met
3 ook, en met 4, enz.
De oplossing is dat we één van de variabelen zomaar gelijk aan 1
stellen.
Dan is het stelsel vergelijkingen wél op te lossen, maar het zou kunnen
dat daar nou breuken uitkomen.
Als dat zo is dan gaan we na afloop alles net zolang vermenigvuldigen
totdat die breuken weg zijn.
In het voorbeeld:
Neem bijvoorbeeld a = 1.
Dan geeft de C-vergelijking dat c = 1.
Dan geeft de H-vergelijking dat d = 2.
Dan geeft de O-vergelijking dat b = 2.
Dat geeft inderdaad de gevonden oplossing.
Maar als je was begonnen met b = 1 dan was het wat moeizamer
gegaan.
Dan had je eerst gevonden a = c en d =
2a en dan geeft de O-vergelijking 2 = 2a
+ 2a ofwel a = 1/2
Dat geeft dus a = 1/2
en b = 1 en c = 1/2
en d = 1 en de vergelijking
1/2CH4
+ O2 →
1/2CO2
+ H2O
Door alles nu met 2 te vermenigvuldigen krijg je toch de goede
oplossing (alhoewel ik eigenlijk nooit heb begrepen waarom
scheikundigen vinden dat er allemaal gehele getallen in zo'n
vergelijking moeten staan). |
| |
|
|
|
| |
|
|
|
| 1. |
Maak de volgende reactievergelijkingen kloppend
door een stelsel vergelijkingen op te stellen en dat stelsel op
te lossen. |
| |
|
|
|
|
| |
a. |
....NH3 + ....O2
→ ....NO
+ .... H2O |
| |
b. |
.... AgNO3 +
....HCl → ....AgCl
+ ....HNO3 |
| |
c. |
....MnSO4 +
.... NaOH →
....Mn(OH)2 + .....Na2SO4 |
| |
d. |
....Fe(OH)3 + ....H2SO4
→ ....Fe2(SO4)3
+ ....H2O |
| |
e. |
....Ca(OH)2 + ....H3PO4
→ ....Ca3(PO4)2
+ ....H2O |
| |
f. |
....Ca(OH)2 + ....P2O5
→ ....Ca3(PO4)2
+ ....H2O |
| |
g. |
....NO2 + ....H2O
+ ....O2 →
....HNO3 |
| |
h. |
....KClO → ....KClO3
+ ....KCl |
|
|
| |
|
|
|
|
| 2. |
Met de reactievergelijking
....CBr4
+ ....HF → ....CBr2F2
+ ....CF3Br + ....HBr
is iets vreemds aan
de hand. |
| |
Leg wiskundig uit wat er met het
stelsel vergelijkingen dat je krijgt aan de hand is.
Wat denk je dat de scheikundige gevolgen zullen zijn? |
| |
|
|
|
|
| |
|
|
|
 |
|
|
© h.hofstede (h.hofstede@hogeland.nl)
|
|
|
|
| |
|
|
|